Spis treściTable of Contents
Jak Twój mikrobiom jelitowy może wpływać na objawy stwardnienia rozsianego (SM) | Enbiosis
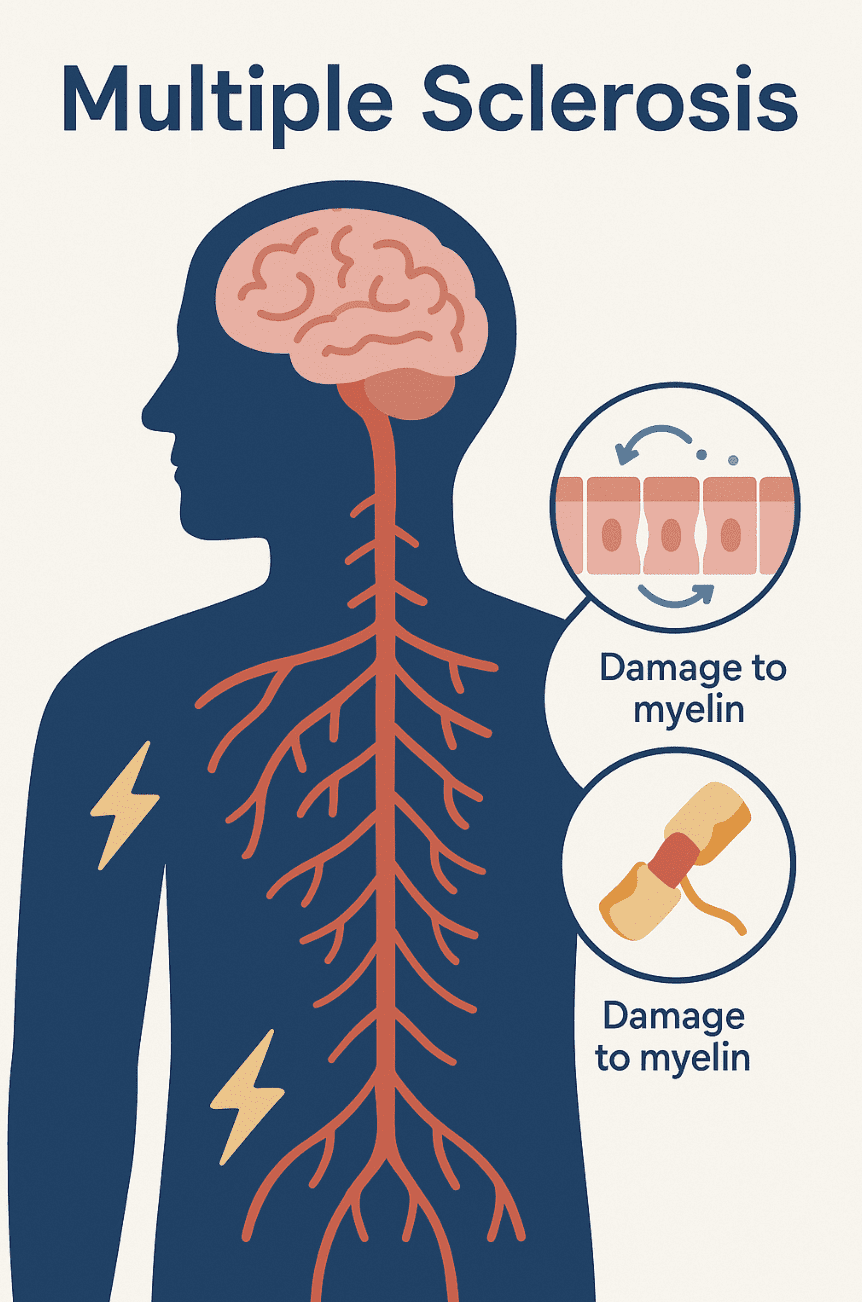
[wideo width=”1920″ height=”1080″ mp4=”https://enbiosis.com/wp-content/uploads/2025/04/Untitled-8-1-1-1-1.mp4″][/wideo] Dowiedz się więcejStwardnienie rozsiane (SM) to przewlekła i nieprzewidywalna choroba neurologiczna, która atakuje ośrodkowy układ nerwowy. Występuje, gdy układ odpornościowy błędnie atakuje ochronną osłonkę otaczającą włókna nerwowe, zwaną osłonką mielinową. Zaburza to kluczowe sygnały nerwowe i może prowadzić do długotrwałego uszkodzenia mózgu i rdzenia kręgowego. Pacjenci z SM doświadczają zróżnicowanych objawów neurologicznych, powszechnie obejmujących zmęczenie, drętwienie lub mrowienie w różnych częściach ciała, skurcze mięśni, sztywność lub spastyczność, trudności w poruszaniu się, problemy ze wzrokiem oraz zmiany poznawcze. Objawy te mogą się znacznie różnić u poszczególnych pacjentów i zależą od lokalizacji i zakresu uszkodzenia nerwów. SM można sklasyfikować na różne typy, które obejmują postać rzutowo-remisyjną, postać wtórnie postępującą i postać pierwotnie postępującą, każda z własnym, charakterystycznym wzorcem progresji. Obecnie nie ma lekarstwa na tę chorobę, jednak dostępnych jest wiele metod leczenia, które mogą pomóc pacjentom w zarządzaniu objawami i spowolnieniu postępu choroby. Chociaż naukowcy wciąż nie są pewni przyczyny SM, powszechnie uważa się, że choroba jest wynikiem złożonych interakcji między genetyką danej osoby a pewnymi czynnikami środowiskowymi, które mogą wpływać na aktywność układu odpornościowego. Jednym z nowych obszarów zainteresowania jest mikrobiom jelitowy, który odgrywa kluczową rolę w regulacji naszej odpowiedzi immunologicznej i kontrolowaniu stanu zapalnego w organizmie.
 Mikrobiom jelitowy a stwardnienie rozsiane – co mówi nauka
Mikrobiom jelitowy a stwardnienie rozsiane – co mówi nauka
Ostatnie badania wykazały wyraźne różnice w mikrobiocie jelitowej osób z SM w porównaniu ze zdrowymi osobami z grupy kontrolnej. Obejmuje to zmiany w składzie społeczności drobnoustrojów jelitowych, a także zmiany w typach metabolitów, które te drobnoustroje produkują. Przyjrzyjmy się bliżej, co mówi nauka:
Dysbioza w SM
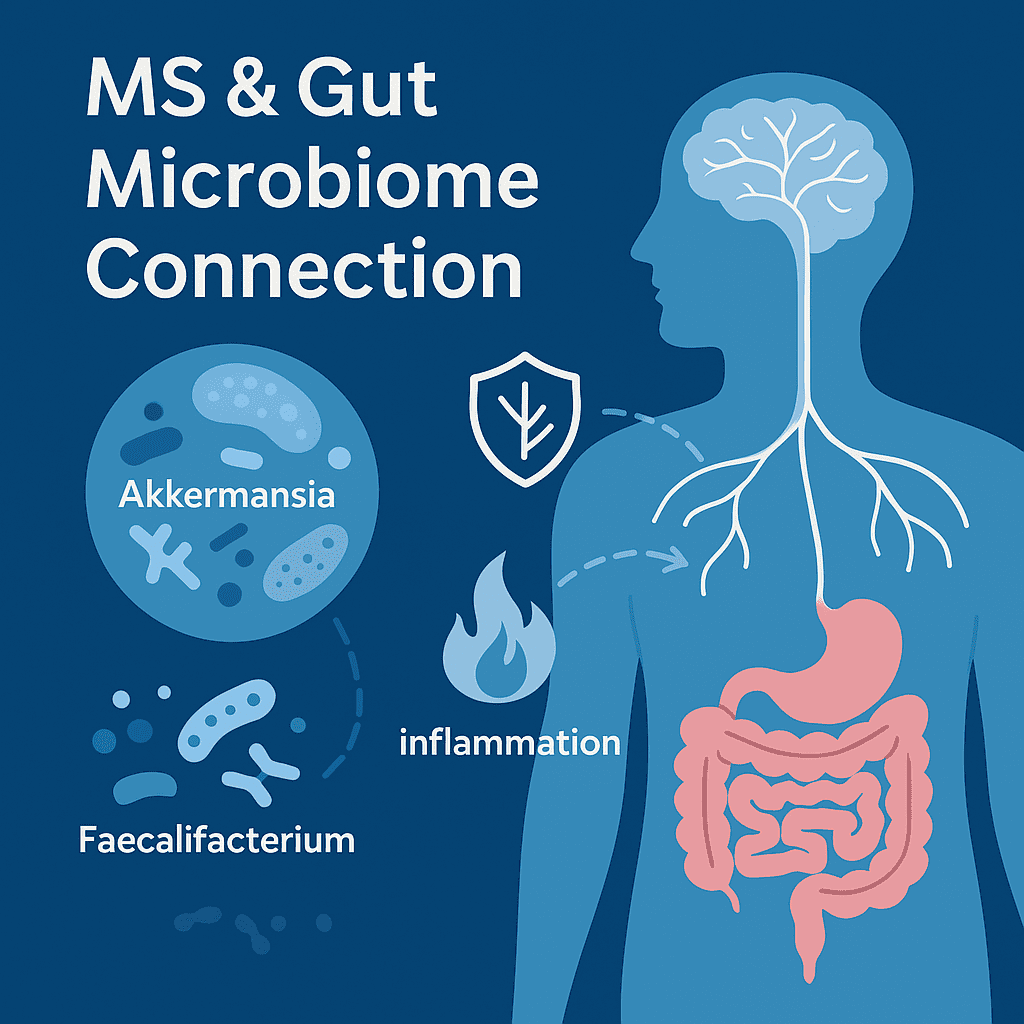
Spójnym odkryciem w licznych badaniach i przeglądach w tej dziedzinie jest obecność dysbiozy jelitowej u osób z SM. Odzwierciedlając to, systematyczny przegląd literatury opublikowany w 2023 roku wyróżnił kluczowe gatunki bakterii, które prawdopodobnie odgrywają rolę w patogenezie SM, w tym Pseudomonas, Mycoplasma, Haemophilus, Blautia, Dorea, Faecalibacterium, Methanobrevibacter, Akkermansia i Desulfovibrionaceae (1).
Badania naukowe wykazały specyficzne zmiany mikrobiologiczne u pacjentów z SM. Na przykład, w Międzynarodowym Badaniu Mikrobiomu Stwardnienia Rozsianego (iMSMS), które porównywało mikrobiom jelitowy 576 pacjentów z SM z genetycznie niespokrewnionymi zdrowymi kontrolami domowymi, badacze zidentyfikowali znacznie podwyższony poziom Akkermansia muciniphila, Ruthenibacterium lactatiformans, Hungatella hathewayi i Eisenbergiella tayi oraz zmniejszenie liczby Faecalibacterium prausnitzii i gatunków Blautia u pacjentów z SM (2).
Podobnie, u pacjentów zarówno z rzutowo-remisyjną, jak i postępującą postacią SM wykazano podwyższony poziom Clostridium bolteae, Ruthenibacterium lactatiformans i Akkermansia oraz zmniejszony poziom Blautia wexlerae, Dorea formicigenerans i Erysipelotrichaceae CCMM (3). Dodatkowo, pacjenci z postępującą postacią SM mieli zwiększoną ilość Enterobacteriaceae i Clostridium g24 FCEY oraz zmniejszoną ilość Blautia i Agathobaculum. Co ciekawe, niektóre typy bakterii Clostridium były powiązane z gorszą niepełnosprawnością i zmęczeniem, podczas gdy zwiększona ilość Akkermansia była powiązana z mniejszą niepełnosprawnością, co sugeruje, że może ona być actually pomocna w SM (2).
Dalsze dowody szczegółowo opisujące te zmiany mikrobiologiczne pochodzą z badania opublikowanego niedawno, w marcu 2025 roku, które wykazało, że u pacjentów z nieleczonym, nowo zdiagnozowanym stwardnieniem rozsianym nastąpiło znaczące zmniejszenie liczby bakterii jelitowych pokrytych immunoglobuliną A (IgA) w porównaniu ze zdrowymi osobami z grupy kontrolnej. Wśród pacjentów z SM zaobserwowano również notable zmiany w specyficznych populacjach bakterii jelitowych. Na przykład, względna obfitość Faecalibacterium prausnitzii była zmniejszona, co jest zgodne z wcześniejszymi badaniami. I odwrotnie, Monoglobus pectinyliticus wykazał zwiększoną względną obfitość i częstość występowania.
Rola metabolitów drobnoustrojów
Zmiany w składzie bakterii jelitowych obserwowane w SM są ważne, ponieważ te drobnoustroje aktywnie produkują ogromną gamę metabolitów podczas trawienia pokarmu i wykonywania swoich funkcji. Te metabolity działają jak sygnały, które mogą zostać wchłonięte do krwiobiegu, podróżować po całym ciele i wpływać na różne procesy, szczególnie odpowiedzi immunologiczne i zapalne.
Kluczową grupą korzystnych metabolitów produkowanych przez bakterie jelitowe są krótkołańcuchowe kwasy tłuszczowe (SCFA), takie jak maślan, propionian i octan. SCFA są niezbędne do utrzymania zdrowej wyściółki jelit, posiadają właściwości przeciwzapalne i pomagają regulować układ odpornościowy. Warto zauważyć, że badania często zgłaszają niższe poziomy SCFA i bakterii je produkujących u osób z SM w porównaniu ze zdrowymi kontrolami (5,6,7). Te zmiany mogą potencjalnie przyczyniać się do zapalnego środowiska związanego z SM.
 W jaki sposób jelita wpływają na SM?
W jaki sposób jelita wpływają na SM?
Ponieważ jelita są ściśle powiązane z wieloma częściami ciała, mogą wpływać na SM poprzez kilka kluczowych szlaków, które omówimy poniżej:
Oś jelita-mózg
Istnieje dwukierunkowa sieć komunikacyjna między naszym przewodem pokarmowym a ośrodkowym układem nerwowym. W kontekście SM, dysbiotyczne środowisko jelitowe może wysyłać sygnały poprzez te szlaki, które mogą promować stan zapalny w mózgu, wpływać na aktywność komórek odpornościowych w OUN i potencjalnie wpływać na integralność bariery krew-mózg (8).
Modulacja układu odpornościowego
Około 70-80% komórek odpornościowych organizmu znajduje się w jelitach (9), a drobnoustroje jelitowe nieustannie komunikują się z nimi, odgrywając kluczową rolę w ich rozwoju, “treningu” i funkcjonowaniu. Gdy nasz mikrobiom jelitowy ulega zachwianiu, może to upośledzać regulację immunologiczną, prowadząc do nadmiernych reakcji immunologicznych lub stanu zapalnego, co jest charakterystyczne dla SM.
Jak dostosowanie mikrobiomu jelitowego może przynieść korzyści w SM?
Dostosowanie mikrobiomu jelitowego za pomocą diety stanowi obiecujące podejście we wspieraniu leczenia stwardnienia rozsianego (SM), ponieważ dieta jest jednym z najskuteczniejszych narzędzi wpływających zarówno na skład, jak i funkcjonalność bakterii jelitowych. Badania nauczne coraz częściej pokazują, że dysbioza jelit — brak równowagi w społeczności drobnoustrojów jelitowych — może przyczyniać się do progresji SM, zakłócając integralność bariery jelitowej i promując systemic stan zapalny. Zdrowy mikrobiom jelitowy wspiera produkcję korzystnych metabolitów, takich jak krótkołańcuchowe kwasy tłuszczowe (SCFA), jak maślan, które pomagają utrzymać ochronną funkcję wyściółki jelit. Gdy ta bariera jest zagrożona z powodu zmniejszonej produkcji SCFA, szkodliwe substancje,包括 składniki bakteryjne i niestrawione cząstki pokarmowe, mogą przedostać się do krwiobiegu, wywołując odpowiedzi immunologiczne i systemic zapalenie — mechanizmy ściśle powiązane z autoimmunologiczną aktywnością obserwowaną w SM (10).
Co więcej, innym kluczowym mechanizmem, poprzez który mikrobiom jelitowy może wpływać na SM, jest mimikra molekularna. Niektóre gatunki bakterii, gdy są nadmiernie reprezentowane w niezrównoważonym jelicie, mogą produkować cząsteczki, które bardzo przypominają składniki ludzkich tkanek, szczególnie osłonkę mielinową izolującą włókna nerwowe. To podobieństwo może wprowadzić w błąd układ odpornościowy, powodując atak na własne białka mieliny organizmu, przyczyniając się do neurodegeneracji w SM. Badania wykazały podobieństwa między składnikami drobnoustrojów z bakterii takich jak Lactobacillus i Clostridium a ludzkimi białkami mieliny, takimi jak białko zasadowe mieliny (MBP) i białko mieliny oligodendrocytów (MOG). To further wspiera potencjał ukierunkowanych strategii modulacji mikrobiomu — szczególnie poprzez spersonalizowane odżywianie — w pomaganiu redukować zapalenie związane z SM i spowalniać postęp choroby.
Jak dostosowanie mikrobiomu jelitowego może przynieść korzyści w SM?
Dieta jest jednym z najpotężniejszych narzędzi, jakie mamy, aby wpływać na nasze społeczności drobnoustrojów jelitowych, w tym na to, które bakterie są obecne w naszych jelitach i ich funkcjonowanie. Rzeczywiście, liczne badania naukowe konsekwentnie podkreślają obiecujący wpływ, jaki dieta może mieć na aktywność i postęp choroby SM (11,12,13).
Aby zoptymalizować potencjalny wpływ, jaki dieta może mieć na pacjentów z SM, ważne jest, abyśmy w pełni zrozumieli specyficzny krajobraz mikrobiologiczny danej osoby. Spersonalizowane odżywianie, oparte na analizie mikrobiomu, może pomóc w osiągnięciu tego spersonalizowanego podejścia. Zamiast zapewniać pacjentom ogólne zalecenia dietetyczne, testowanie mikrobiomu pomaga informować o spersonalizowanych planach dietetycznych. Ta ukierunkowana porada dietetyczna i dotycząca stylu życia może pomóc stymulować wzrost korzystnych bakterii, zwiększać produkcję pomocnych metabolitów i przywracać równowagę jelit w kierunku bardziej korzystnej ogólnej społeczności drobnoustrojów.
[wideo width=”1920″ height=”1080″ mp4=”https://enbiosis.com/wp-content/uploads/2025/04/loom-video-for-Lisa.mp4″][/wideo]Personalizacja zarządzania SM z ENBIOSIS
Zarządzanie SM to złożona podróż, zwykle wymagająca podejścia łączącego leczenie medyczne, dostosowania dietetyczne i styl życia oraz inne strategie wspomagające. Jak omówiono w tym artykule, mikrobiom jelitowy jest uważany za kluczowy czynnik przyczyniający się do procesów zapalnych obserwowanych w SM. A więc, dieta może być ważnym modulatorem choroby, ponieważ bezpośrednio wpływa na mikrobiom jelitowy.
W Enbiosis oferujemy zaawansowaną analizę mikrobiomu jelitowego z wykorzystaniem najnowocześniejszej technologii sekwencjonowania połączonej z wyrafinowanymi algorytmami napędzanymi sztuczną inteligencją. Pozwala nam to wygenerować szczegółowy obraz unikalnego ekosystemu jelitowego danej osoby, który przekładamy na praktyczne i możliwe do wdrożenia spersonalizowane zalecenia żywieniowe.
Odwiedź naszą stronę internetową, aby dowiedzieć się więcej o podejściu Enbiosis, lub skontaktuj się z nami poprzez stronę kontaktową, jeśli masz jakieś konkretne pytania.
Dowiedz się więcejReferencje:
1. Dunalska, A., Saramak, K., & Szejko, N. (2023). The Role of Gut Microbiome in the Pathogenesis of Multiple Sclerosis and Related Disorders. Cells, 12(13), 1760.
2. Zhou, X., Baumann, R., Gao, X., Mendoza, M., Singh, S., Katz Sand, I., Xia, Z., Cox, L. M., Chitnis, T., Yoon, H., Moles, L., Caillier, S. J., Santaniello, A., Ackermann, G., Harroud, A., Lincoln, R., Gomez, R., González Peña, A., Digga, E., … Baranzini, S. E. (2022). Gut microbiome of multiple sclerosis patients and paired household healthy controls reveal associations with disease risk and course. Cell, 185(19), 3467–3486.e16.
3. Cox, L. M., Maghzi, A. H., Liu, S., Tankou, S. K., Dhang, F. H., Willocq, V., Song, A., Wasén, C., Tauhid, S., Chu, R., Anderson, M. C., De Jager, P. L., Polgar-Turcsanyi, M., Healy, B. C., Glanz, B. I., Bakshi, R., Chitnis, T., & Weiner, H. L. (2021). Gut Microbiome in Progressive Multiple Sclerosis. Annals of Neurology, 89(6), 1195-1211.
4 Gupta, V. K., Janda, G. S., Pump, H. K., Lele, N., Cruz, I., Cohen, I., Ruff, W. E., Hafler, D. A., Sung, J., & Longbrake, E. E. (2025). Alterations in gut microbiome-host relationships after immune perturbation in patients with multiple sclerosis. Neurology: Neuroimmunology & Neuroinflammation, 12(2).
5. Levi, I., et al. (2025). Potential role of indolelactate and butyrate in multiple sclerosis revealed by integrated microbiome-metabolome analysis. Cell Reports Medicine, 2(4), Article 100246.
6. Ling, Z., Cheng, Y., Yan, X., Shao, L., Liu, X., Zhou, D., Zhang, L., Yu, K., & Zhao, L. (2020). Alterations of the Fecal Microbiota in Chinese Patients With Multiple Sclerosis. Frontiers in Immunology, 11, 590783.
7. Moles, L., Delgado, S., Gorostidi-Aicua, M., Sepúlveda, L., Alberro, A., Iparraguirre, L., Suárez, J. A., Romarate, L., Arruti, M., Muñoz-Culla, M., Castillo-Triviño, T., Otaegui, D., & Microbiome Study Consortium, M. S. (2022). Microbial dysbiosis and lack of SCFA production in a Spanish cohort of patients with multiple sclerosis. Frontiers in Immunology, 13, 960761.
8. Parodi, B. (2021). The Gut-Brain Axis in Multiple Sclerosis. Is Its Dysfunction a Pathological Trigger or a Consequence of the Disease? Frontiers in Immunology, 12, 718220. Wiertsema, S. P., Garssen, J., & J Knippels, L. M. (2021).
9. The Interplay between the Gut Microbiome and the Immune System in the Context of Infectious Diseases throughout Life and the Role of Nutrition in Optimizing Treatment Strategies. Nutrients, 13(3), 886.
10. Bigdeli, A., Ghaderi-Zefrehei, M., Lesch, B. J., Behmanesh, M., & Arab, S. S. (2024). Bioinformatics analysis of myelin-microbe interactions suggests multiple types of molecular mimicry in the pathogenesis of multiple sclerosis. PLOS ONE, 19(12), e0308817.
11. Stoiloudis, P., Kesidou, E., Bakirtzis, C., Sintila, A., Konstantinidou, N., Boziki, M., & Grigoriadis, N. (2022). The Role of Diet and Interventions on Multiple Sclerosis: A Review. Nutrients, 14(6), 1150.
12. Nan, H. (2024). Causal effects of dietary composition on multiple sclerosis risk and severity: A Mendelian randomization study. Frontiers in Nutrition, 11, 1410745.
13. Krivić, A. D., Begagić, E., Hadžić, S., Bećirović, A., Bećirović, E., Hibić, H., Lihić, L. T., Vukas, S. K., Bečulić, H., Kasapović, T., & Pojskić, M. (2025). Unveiling the Important Role of Gut Microbiota and Diet in Multiple Sclerosis. Brain Sciences, 15(3), 253.